Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Содержание
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь. Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок),
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения α для некоторых оксидов металлов
| металл | оксид | α | металл | оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Это интересно: Преимущества полимербетона перед другими материалами: Обзор
Коррозия в жидкостях-неэлектролитах
К неэлектропроводным жидким средам (т.е. жидкостям-неэлектролитам) относят такие органические вещества, как:
- бензол;
- хлороформ;
- спирты;
- тетрахлорид углерода;
- фенол;
- нефть;
- бензин;
- керосин и т.д.
Кроме того, к жидкостям-неэлектролитам причисляют небольшое количество неорганических жидкостей, таких как жидкий бром и расплавленная сера.
При этом нужно заметить, что органические растворители сами по себе не вступают в реакцию с металлами, однако, при наличии небольшого объема примесей возникает интенсивный процесс взаимодействия.
Увеличивают скорость коррозии находящиеся в нефти серосодержащие элементы. Также, усиливают коррозийные процессы высокие температуры и присутствие в жидкости кислорода. Влага интенсифицирует развитие коррозии в соответствии с электромеханическим принципом.
Еще один фактор быстрого развития коррозии — жидкий бром. При нормальных температурах он особенно разрушительно воздействует на высокоуглеродистые стали, алюминий и титан. Менее существенно влияние брома на железо и никель. Самую большую устойчивость к жидкому брому показывают свинец, серебро, тантал и платина.
Расплавленная сера вступает в агрессивную реакцию почти со всеми металлами, в первую очередь со свинцом, оловом и медью. На углеродистые марки стали и титан сера влияет меньше и почти совсем разрушает алюминий.
Защитные мероприятия для металлоконструкций, находящихся в неэлектропроводных жидких средах, проводят добавлением устойчивым к конкретной среде металлов (например, сталей с высоким содержанием хрома). Также, применяются особые защитные покрытия (например, в среде, где содержится много серы, используют алюминиевые покрытия).
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
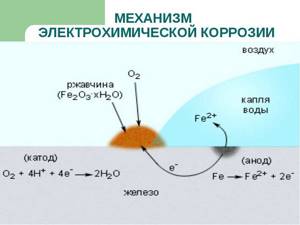
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.
Органосиликатные покрытия
Для качественной защиты от коррозии рекомендуется применение металлов с высоким уровнем гидрофобности, непроницаемости в водных, газовых и паровых средах. К числу таких материалов относятся органосиликаты.
Химическая коррозия практически не распространяется на органосиликатные материалы. Причины этого кроются в повышенной химической устойчивости таких композиций, их стойкости к свету, гидрофобных качествах и невысоком водопоглощении. Также органосиликаты устойчивы к низким температурам, обладают хорошими адгезивными свойствами и износостойкостью.
Проблемы разрушения металлов из-за воздействия коррозии не исчезают, несмотря на развитие технологий борьбы с ними. Причина в постоянном возрастании объемов производства металлов и все более сложных условий эксплуатации изделий из них. Окончательно решить проблему на данном этапе нельзя, поэтому усилия ученых сосредоточены на поисках возможностей по замедлению коррозионных процессов.
Органические покрытия против коррозии
Наиболее удачно решение по борьбе с коррозией – органические смеси для предотвращения ржавчины. Преимуществами органических покрытий можно назвать простоту нанесения, разнообразие дизайнов, легкость восстановления испорченного покрытия и приемлемая стоимость. Однако, недостатком органических растворов является их неустойчивость к нагреванию. Среди органических антикоррозийных растворов выделяют:
- лаки;
- краски;
- эмали;
- пластификаторы;
- пленкообразователи.
Стоит отметить, что большую роль в успешной антикоррозийной защите играет качество смеси (то есть лака, краски или эмали), которой вы покрываете металл. От ее состава напрямую зависит, сколько прослужит металл. Правильное соотношение краски, смягчителя, катализаторов и других компонентов напрямую влияет на долговечность защиты.
Другими важными факторами являются:
- качество подготовки поверхности;
- метод нанесения;
- толщина покрытия.
Зачастую эффективнее и выгоднее воспользоваться услугами профессионалов, если необходимо защитить дорогостоящее металлическое оборудование. На производстве специалисты обладают возможностями, гарантирующими долгосрочную и качественную защиту металла от ржавчины:
- химическая обработка металлов;
- погружение в расплав;
- напыление;
- электролитическое осаждение;
- гуммирование;
- покрытие смазками и пастами;
- покрытие смолами и пластмассами.
Это интересно: Холодная сварка по пластику и ее применение
Коррозия в неэлектролитных жидкостях
Общие сведения
К жидким неэлектропроводным средам (а точнее, неэлектролитным жидкостям) можно отнести такие органические вещества, к примеру:
- Керосин.
- Бензол.
- Бензин.
- Хлороформ.
- Нефть.
- Спирты.
- Фенол.
- Тетрахлорид углерода.
Еще к таким жидкостям причисляют малое количество жидкостей неорганического типа, к примеру, жидкий бром и сера, которая расплавлена. При этом следует отметить, что растворители органического типа сами по себе не будут вступать в реакцию с металлами, но, при наличие маленького объема примесей появляется интенсивный процесс взаимодействий. Скорость коррозии увеличивают находящиеся в нефти элементов с содержанием серы.
Также, для усиления коррозийных процессов нужны высокие температуры. Влага будет интенсифицировать развитие коррозии по электромеханическому принципу. Еще одним фактором быстрого коррозийного развития – бром в жидком виде. При нормальной температуре он особенно разрушительно будет воздействовать на высокоуглеродистые стали, титан и алюминий. Менее существенно воздействие брома на никель и железо, а самую большую устойчивость к жидкому типу брома будут показывать тантал, свинец, платина и серебро.
Расплавленная сера будет вступать в агрессивные реакции практически со всеми металлами, и в первую очередь с оловом, свинцом и медью. На углеродистые марки титан и стали сера будет влиять меньше, а еще практически полностью разрушает алюминий. Защитные действия для металлических конструкций, которые находятся в неэлектропроводных средах жидкого типа, проводят добавлением устойчивым к определенной среде металлом (к примеру, сталей с большим содержанием хрома). Еще используются особые защитные покрытия (к примеру, в среде, где есть много серы, применяют алюминиевые покрытия).
Способы защиты от коррозии
Способы борьбы с коррозией будут включать в себя:
- Обработку главного металла защитным слоем (например, нанесение лакокрасочного материала).
- Применение ингибиторов (арсенитов или хроматов).
- Внедрение материалов, которые устойчивые к коррозийным процессам.
Подбор определенного материала будет зависеть от потенциальной эффективности (тут имеется виде финансовой и технологической) ее применения.
Современные принципы по защите металла от химической коррозии металла будут основаны на следующих методиках:
- Улучшение споротивляемости химического типа. Себя смогли успешно зарекомендовать устойчивые материалы (стекло, высокополимерный пластик и керамика).
- Изоляция материала от агрессивных сред.
- Уменьшение агрессивности технологической среды – в роли примеров таких действий можно выполнить нейтрализацию и удалить кислотность в коррозионой среде, а еще применять различные ингибиторы.
- Защита электрохимического типа (накладывание внешнего тока).
Указанные методики будут подразделяться на две группы:
- Повышение сопротивляемости химического типа и изолирование будет применяться до того, как металлическая конструкция запускается в использовании.
- Уменьшение агрессивности и защиты электрохимического типа применяется уже при применении изделий и металла. Использование обеих методик дает возможность внедрять новые защитные методы, и в результате защита будет обеспечиваться изменением эксплуатационных условий.
Одним из самых часто используемых методов защиты металла является антикоррозийное гальваническое покрытие, но это экономически нерентабельно при большой площади поверхности. Причина в больших тратах на процесс подготовки. Ведущее место среди методов по защите будет занимать покрытие металла лакокрасочным материалом.
Популярность такого способа борьба с коррозией обусловлена совокупностью факторов:
- Высокие свойства защиты (отталкивание жидкостей, гидрофобность, невысокая газовая проницаемость и паропроницаемость).
- Технологичность.
- Большие возможности для решений декоративного типа.
- Ремонтопригодность.
- Экономическая оправданность.
В то же время применение широкодоступных материалов тоже имеет недостатки:
- Неполное уважение поверхности металла.
- Нарушено сцепление покрытия с главным металлом, покрытием против коррозии, и начнет способствовать коррозии.
- Пористость, которая приводит к повышенному уровню проницаемости влаги.
И все-таки, окрашенная поверхность защищает металлы от процессов коррозии даже при локальном повреждении пленки, тогда как несовершенные покрытия гальванического типы способны даже ускорить коррозию.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия.
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
← Задачи к разделу Коррозия металлов
Задачи к разделу Электролиз солей →